Estereoisomeria = isomeria (mesma fórmula molecular em compostos diferentes) espacial (arranjo dos átomos no espaço tridimensional). O termo "ester...
Estereoisomeria = isomeria (mesma fórmula molecular em compostos
diferentes) espacial (arranjo dos átomos no espaço tridimensional). O termo "estereoisomeria" engloba isômeros conformacionais e isômeros de configuração.
CONFORMAÇÃO:
Conformação é o arranjo espacial da molécula; confórmeros são gerados através da rotação de uma ou mais ligações simples da molécula.
Desta forma, o isomerismo (mesma fórmula molecular em compostos diferentes) conformacional ocorre quando existe um arranjo espacial não idêntico de átomos numa molécula, que é resultante da rotação em torno de uma ou mais ligações simples.
Cada conformação = CONFÓRMERO ou ROTÂMERO e são interconvertidos pela rotação da ligação simples. Portanto, uma conformação pode ser mudada sem a quebra de ligações químicas. A Projeção de Newman é constantemente utilizada para avaliação de confórmeros.
 |
| À esquerda: Projeções de Newman. À direita: representações em cavalete. |
Ligações duplas e triplas impossibilitam a geração de confórmeros devido à "maior intimidade" (maior proximidade) de ligação entre os átomos gerada pelo maior número de ligações. Os confórmeros são compostos que, devido à facilidade com que se interconvertem, são difíceis de separar fisicamente.Para um confórmero se interconverter no outro é necessário que a barreira energética para fazer rodar a ligação simples seja baixa.
ATROPOISOMERISMO (SEM ROTAÇÃO):
É um tipo de estereoisomerismo característico de sistemas onde a rotação livre em torno de uma ligação simples é impedida, produzindo uma barreira energética suficientemente elevada, de modo a permitir o isolamento ou detecção dos diferentes rotâmeros.
Geralmente são biarilas com substituintes em orto. São moléculas quirais com imagens especulares não sobreponíveis, mas não possuem centros quirais.
ATROPOISOMERISMO (SEM ROTAÇÃO):
É um tipo de estereoisomerismo característico de sistemas onde a rotação livre em torno de uma ligação simples é impedida, produzindo uma barreira energética suficientemente elevada, de modo a permitir o isolamento ou detecção dos diferentes rotâmeros.
Geralmente são biarilas com substituintes em orto. São moléculas quirais com imagens especulares não sobreponíveis, mas não possuem centros quirais.
CONFIGURAÇÃO:
Configuração é o modo como estão conectados os segmentos constituintes de uma molécula. A configuração só pode ser alterada com a quebra de ligações químicas.
Isômeros de configuração podem ser divididos em isômeros geométricos e isômeros ópticos.
ISÔMEROS GEOMÉTRICOS:
Isômeros geométricos são os isômeros CIS e TRANS ou Z e E, onde:
- Cis ou Z = quando os ligantes de maior massa situam-se do mesmo lado da molécula.
- Trans ou E = quando os ligantes de maior massa não se situam do mesmo lado da molécula.
ISÔMEROS ÓPTICOS:
Isômeros ópticos são os isômeros R ou S; + ou -. Caso um isômero seja dextrógiro (substâncias que desviam a luz polarizada para a direita) ele pode ser sinalizado como "d" ou "+", caso seja ou levógiro (substâncias que desviam a luz polarizada para a esquerda), é sinalizado como "l" ou "-". Ao utilizar um polarímetro para determinar qual o isômero é dextrógiro e qual é levógiro, têm-se a configuração relativa de um em relação ao outro. Ao finalizar a identificação com a determinação de qual composto é R ou S, têm-se a configuração absoluta.
Como requisito para isomeria óptica é necessário que um composto seja classificado como quiral, pois um composto quiral é opticamente ativo enquanto um composto aquiral é inativo.
A quiralidade é uma propriedade geométrica: um objeto é quiral quando não é sobreponível com sua imagem em um espelho, e é aquiral quando é sobreponível. O maior exemplo de quiralidade é o do carbono central assimétrico (um carbono ligado à quatro ligantes diferentes).
Um método alternativo, mas satisfatório, para estabelecer se uma molécula é quiral ou aquiral consiste na determinação dos elementos de simetria presentes na molécula, onde compostos quirais não possuem plano de simetria e compostos aquirais possuem.
 |
| Enantiômeros (estereoisômeros que são imagens especulares um do outro, não sobreponíveis). Pode-se identificar o carbono central quiral (com quatro ligantes diferentes). |
Enantiômeros
são compostos estereoisômeros que são imagens especulares (reflexo de um espelho) um do outro,
portanto não sobreponíveis (como nossas mãos). Eles possuem configurações absolutas opostas.
Um método alternativo, mas satisfatório, para estabelecer se uma molécula é quiral ou aquiral consiste na determinação dos elementos de simetria presentes na molécula, onde compostos quirais não possuem plano de simetria e compostos aquirais possuem.
 |
| O composto trans possui quiralidade por não possuir plano de simetria e portanto também possui isomeria óptica (além da geométrica). |
Diastereoisômeros são um tipo de estereoisômeros. Ocorre quando dois ou mais estereoisômeros de um composto possuem diferentes configurações em um ou mais (MAS NÃO EM TODOS, pois neste caso não seriam diferentes dos enantiômeros) estereocentros (centros quirais), portanto não são imagens especulares, mas também não são sobreponíveis. Exemplos:
Quando diastereoisômeros diferem entre si em apenas um estereocentro, são chamados de epímeros.
Diastereoisômeros possuem diferentes propriedades, enquanto enantiômeros possuem propriedades similares.
Cada estereocentro gera a possibilidade de duas novas configurações, aumentando o número de isômeros por 2. Portanto, o número de isômeros de configuração pode ser determinado por 2^n, onde n é o número de centros quirais da molécula.
Outras classificações (FARMÁCIA):
- Eutômero: isômero que apresenta atividade desejada.
- Distômero: NÃO apresenta atividade desejada ou apresenta atividade desejada DIMINUÍDA.
- Proporção eudísmica: razão entre as potências de 2 enantiômeros. Indicação do grau de seletividade. Quanto menor a proporção eudísmica, menor a afinidade. Quanto maior, maior afinidade, portanto maior é a potência.
EXTRA: SIMETRIA
Há quatro elementos de simetria de interesse na estereoquímica:
Há quatro elementos de simetria de interesse na estereoquímica:
1. Eixos simples de simetria, quando a operação sobre um eixo Cn, em que n = 360°/giro°, conduz a uma estrutura indistinguível da inicial. Por exemplo:
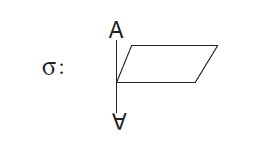
2. Plano de reflexão ( σ) corresponde a um plano de simetria que divide a molécula em duas metades idênticas. Pode ser visualizado também como um espelho plano no qual metade da molécula reflete sua imagem enantiomérica:
3. Ponto de simetria (i) é um ponto formal no centro da molécula com referência ao qual cada átomo presente encontra seu equivalente ao estender uma linha imaginária com a mesma longitude da que o une a i:
4. Os eixos de rotação-reflexão (Sn) estão presentes em moléculas que, ao serem giradas em tal eixo um ângulo de 360º/n, e então refletidas através de um plano perpendicular ao eixo, produzem uma estrutura idêntica à original. Por exemplo:
_________________________________________
Referências:
- JUARISTI, Eusebio; STEFANI, Hélio A. Introdução à estereoquímica e à análise conformacional. Bookman Editora, 2012.
- COLÉGIO WEB. Isomeria óptica em compostos cíclicos. Disponível em <https://www.colegioweb.com.br/isomeria-optica/isomeria-optica-em-compostos-ciclicos.html>.
- LIBRETEXTS - CHEMISTRY. Diastereomers. Disponível em <https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Supplemental_Modules_(Organic_Chemistry)/Chirality/Diastereomers>.


![[feature]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgtWSkwir_DBe-xiNhqqLNu2ybXxvBZgVDiJVh1vjw3SS07gO7AijfiJUwHcvLiyGEwqFB0OxZJKT5s0cUfDcWuuEWWShnQDSaqY0VlHlb-jBtV_t5GNkIGaP9nqSl8Z6legfi0iJZdnGG82R5Ai8NXsAdOVjgtkWCpYBWmk7TJ--SWigjMJBZx8dDy6Q/s16000/cc1.png)






















COMENTÁRIO(S)