Hibridização ou Hibridação de orbitais é uma interpenetração (mistura) que dá origem a novos orbitais, (de maneira favorável à formação de uma geom...
O que é hibridização de orbitais?
Hibridização ou Hibridação de orbitais é uma interpenetração (mistura) que dá origem a novos orbitais, (de maneira favorável à formação de uma geometria adequada para a ligação) em igual número, denominados orbitais híbridos. A hibridização é determinada pelo arranjo.
O conceito de hibridização é apresentado muitas vezes com enfoques diferentes, incompleto e sem a profundidade necessária para seu total entendimento. Como no ensino médio, onde os alunos são apresentados somente à hibridização dos orbitais do carbono.
Nesse texto, entretanto, abordarei o assunto de forma mais abrangente (como nas universidades), mas ao mesmo tempo de forma simplificada e objetiva.
Dando início ao assunto - Hibridização do Carbono:
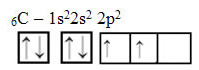
Vou dar uma colher de chá aqui. Para começar a entender o conceito, começaremos com o básico, ou seja, com o caso do carbono. Sabe-se que a única forma do carbono efetuar suas 4 ligações é por meio de seus elétrons (desemparelhados) em seus orbitais atômicos. Como assim? Bom, observe abaixo a distribuição eletrônica do carbono e sua distribuição nos orbitais.
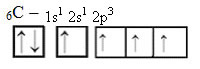
É possível perceber que no orbital 2p, existem somente 2 elétrons desemparelhados (sozinhos) e um orbital totalmente vazio. Dessa forma, o carbono só poderia se ligar duas vezes. Mas não é isso que acontece.A explicação para sua tetravalência se dá pelo fato de o átomo de carbono ter, antes da reação, um dos elétrons 2s promovido ao subnível 2p.
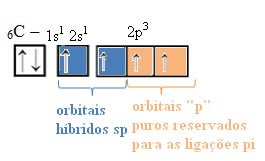
Agora sim! De acordo com a imagem acima agora temos 4 elétrons desemparelhados, devidamente aconchegados nos orbitais do carbono e esperando novos elétrons para efetuar as ligações. Para o caso da hibridização sp, temos a imagem abaixo:
De forma análoga, a hibridização sp² e sp³ possuem respectivamente 1 e nenhum orbital "p" puro reservado para as ligações pi (ligações que servem para a aproximação de átomos já ligados através das ligações sigma).
A molécula de BeF2 e a explicação do orbital híbrido sp:
Considere a molécula de BeF2 (sabe-se experimentalmente que ela existe). O Berílio possui uma distribuição eletrônica de 1s² 2s² e portanto não existem elétrons desemparelhados disponíveis para as ligações. E agora?
Bom, sabemos que existem dois átomos ligados ao átomo central e não existem pares de elétrons não ligantes no mesmo. Portanto, temos uma geometria linear com ângulos de 180 graus. Sabemos também que um elétron de Be é compartilhado com cada um dos elétrons desemparelhados do F.
Seguindo o exemplo do carbono, poderíamos promover um elétron do orbital 2s no Be para o orbital
2p para obtermos dois elétrons desemparelhados para a ligação. Mas a geometria ainda não estaria explicada. Contudo, podemos solucionar o problema admitindo que o orbital 2s e um orbital 2p no Be misturam-se ou formam um orbital híbrido. Esse orbital híbrido é chamado de sp.
Observação: Já que somente um dos orbitais 2p do Be foi utilizado na hibridização, ainda existem dois orbitais p não-hibridizados no Be
Orbitais híbridos sp²:
Os orbitais híbridos sp² são formados com um orbital s e dois orbitais p (3 orbitais disponíveis para ligações sigma e 1 orbital disponível para ligação pi). Consequentemente, resta um orbital p não-hibridizado. Os grandes lóbulos dos híbridos sp² encontram-se em um plano trigonal, portanto, todas as moléculas com arranjos trigonais planos têm orbitais sp² no átomo central.
Orbitais híbridos sp³:
Os orbitais híbridos sp³ são formados a partir de um orbital s e três orbitais p (4 orbitais disponíveis para ligações sigma). Conseqüentemente, há quatro lóbulos grandes. Cada lóbulo aponta em direção ao vértice de um tetraedro e o ângulo entre eles é de 109,5 graus. Todas as moléculas com arranjos tetraédricos são hibridizadas sp³.
Um exemplo de hibridização sp³ é a hibridização do oxigênio da molécula de água ao lado. Percebe-se dois domínios ligantes e 2 domínios não-ligantes (elétrons do oxigênio que não participam das ligações). Como no total temos 4 domínios, o arranjo é tetraédrico, entretanto, como temos 2 domínios não-ligantes, temos uma geometria angular.
Abaixo temos um pedaço de um diagrama que mostra os tipos de geometria de acordo com a quantidade de domínios ligantes e não-ligantes. O destaque em vermelho é para mostrar o caso da molécula de água.
A tabela completa, se encontra disponível para download AQUI.
Hibridização envolvendo orbitais d:
Uma vez que existem apenas três orbitais p, os arranjos octaédricos e de bipirâmide trigonal devem envolver os orbitais d. Os arranjos de bipirâmide trigonais necessitam de hibridização sp³d e os arranjos octaédricos requerem hibridização sp³d².
Observação: Somente elementos do terceiro período em diante apresentam hibridização com orbitais d, já que a expansão do octeto implica nisto.
Regra geral:
A maneira mais rápida de descobrir a hibridização é construir a estrutura de Lewis e contar quantos domínios o referido átomo possui (ligantes e não-ligantes). Dessa forma, você saberá o arranjo e dentro desse arranjo, todas as geometrias possíveis possuem tal hibridização.
Se você acessou a tabela completa, mencionada no tópico de hibridização sp³ deste artigo, saberá do que estou falando.
Concluindo, se você possui uma molécula de arranjo linear (2 átomos ligados ao átomo central), o átomo central possui hibridização sp. Se você possui uma molécula de arranjo trigonal plana, o átomo central possuirá hibridização sp² nas duas geometrias originadas deste arranjo (trigonal plana (com três elementos ligados ao átomo central) e angular (com dois elementos ligados ao átomo central e um par de elétrons isolados)). Assim vai até o arranjo octaédrico, cujas geometrias têm o átomo central hibridizado em sp³d².
_________________________________________
Referências:
Brasil Escola e Química Nova na Escola - Sociedade Brasileira de Química.
Slide do Prof. Glaucio B. Ferreira - Instituto de Química (UFF). Aula de Química Geral de 2013.1, Ligações Químicas.


![[feature]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgbsTMnyFX9GlzMpIzx50_XhJtezb8Gtmn3POCcD8D3BAaiW06Qp2S0GDdC6RJeokcnsfgrLl-E34WA-kkkPUTD_G2At5sOBAKIi4_UD6kugwBIL7kpzv5jP-BAVRPF7KuYjLn65K28-wn6VbpOBgUdU6e05mKxzS6AUu_W230dXVwY5qCEvgDPNDmeZg/s16000/zzz.png)





















COMENTÁRIO(S)